Termoquimica y electroquimica
Introducción
La energía eléctrica es una de las formas de energía de mayor importancia práctica para la vida contemporánea. Un día sin energía eléctrica, ya sea por fallas de la compañía que suministra la luz o por falta de baterías, es inconcebible en nuestra sociedad tecnológica. El área de la química que estudia la conversión entre la energía eléctrica y la energía química es la electroquímica. Los procesos electroquímicos son reacciones redox en donde la energía liberada por una reacción espontánea se transforma en electricidad, o la electricidad se utiliza para inducir una reacción química no espontánea. A este último proceso se le conoce como electrólisis.
La Termoquímica es una subdisciplina de la fisicoquimica que estudia los cambios de calor en procesos de cambio químico, como lo son las reacciones químicas. Se puede considerar que las reacciones químicas se producen a presión constante (atmósfera abierta, es decir, P=1 atm), o bien puede considerarse que se producen a volumen constante (el del receptáculo donde se estén realizando).
Primer principio de la termoquímica
Es un principio que refleja la conservación de la energía en el contexto de la termodinámica y establece que si se realiza trabajo sobre un sistema o bien este intercambia calor con otro, la energía interna del sistema cambiará.
"La variacion de la energia interna de un sistema es igual al calor desprendido o absorbido por el sistemas mas el trabajo realizado por o sobre el sistema"
Veamos el ejemplo de la combustión del metano:
Esta reacción libera en condiciones estandar a 25ºC 803 KJ/mol. Como es un calor desprendido (reacción exotérmica) lo consideramos negativo, y es el calor que desprende la combustión de un mol de metano a presión constante, es decir, su entalpía de combustión.
Como curiosidad quiero adjuntar la foto de un trozo de metano hídrico ardiendo. El metano hídrico es hielo que tiene atrapado metano en su estructura, es estable a bajas temperaturas y altas presiones.
Existen importantes reservas de metano hídrico en el permafrost y también en los fondos marinos, siendo una posible fuente de energía en un futuro cercano.
Ley de Hess
Germain Henry Hess (Ginebra, 1802-San Petesburgo, 1850) fue un fisicoquímico ruso de origen suizo que sentó las bases de la termodinámica actual. Trabajó fundamentalmente la química de gases, y enunció la ley que nos disponemos a comentar ahora:
- "En una reacción química expresada como la suma (o diferencia) algebraica de otras reacciones químicas, puesto que es función de estado, la entalpía de reacción global es también la suma (o diferencia) algebraica de las entalpías de las otras reacciones."
Consideremos la reacción:
A 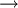 B
B
Y supongamos la existencia de las siguientes reacciones intermedias, de 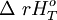 conocida:
conocida:
A 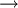 C
C
D 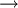 C
C
D 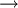 B
B
Vemos que podemos montar un ciclo termodinámico tal que, en vez de ir de A a B directamente, pasemos por todas las reacciones intermedias antes descritas:
A 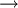 C
C 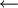 D
D 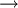 B
B
Como la entalpía es una función de estado, 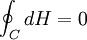 . El proceso no depende del camino, y, por lo tanto, es indiferente que la hagamos directamente o teniendo en cuenta las demás reacciones.
. El proceso no depende del camino, y, por lo tanto, es indiferente que la hagamos directamente o teniendo en cuenta las demás reacciones.
Nótese que la reacción D 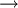 C va en el sentido opuesto al que nos interesa para cerrar el ciclo. Por ello, debemos invertir la dirección del flujo energético para obtener la reacción que queremos, y eso se logra cambiando el signo de la variación entálpica. Es decir,
C va en el sentido opuesto al que nos interesa para cerrar el ciclo. Por ello, debemos invertir la dirección del flujo energético para obtener la reacción que queremos, y eso se logra cambiando el signo de la variación entálpica. Es decir,
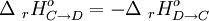 .
.
Teniendo esto en cuenta, la entalpía de la reacción que queremos será:
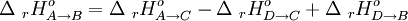
En ocasiones, deberemos multiplicar la entalpía de reacción de una de las intermediarias por algún coeficiente estequiométrico para que se cumpla la relación lineal entre las diferentes variaciones de entalpías.
La Electroquímica es una rama de la química que estudia la transformación entre la energía electrica y la energía química. En otras palabras, las reacciones quimicas que se dan en la interfase de un conductor eléctrico (llamado electrodo, que puede ser un metal o un semiconductor) y un conductor iónico pudiendo ser una disolucion y en algunos casos especiales, un sólido.
Si una reacción química es conducida mediante un voltaje aplicado externamente, se hace referencia a una electrolisos, en cambio, si el voltaje o caida de potencial electrico, es creado como consecuencia de la reacción química , se conoce como un "acumulador de energía electrica", también llamado batería o celda galvánica.
Las reacciones químicas donde se produce una transferencia de electrones entre moléculas se conocen como reacciones redox, y su importancia en la electroquímica es vital, pues mediante este tipo de reacciones se llevan a cabo los procesos que generan electricidad o en caso contrario, es producido como consecuencia de ella.
En general, la electroquímica se encarga de estudiar las situaciones donde se dan reacciones de oxidacion y reduccion encontrandose separadas, físicamente o temporalmente, se encuentran en un entorno conectado a un circuito electrico.

¿Que son las celdas voltaicas de uso practico?
Son aquellas que transforman la energía química en energía eléctrica, también se denomina Celdas o Pilas Electroquímicas. Inicialmente se observó que al sumergir algunos metales en soluciones se producían reacciones con liberación de calor no utilizado
¿Que son las celdas electroliticas?
Se denomina celda electrolítica al dispositivo utilizado para la descomposición mediante corriente eléctrica de sustancias ionizadas denominadas electrolitos. Los electrolitos pueden ser ácidos, bases o sales. Al proceso de disociación o descomposición realizado en la celda electrolítica se le llama electrólisis
¿Para que sirve la electroquimica?
Sirve para determinar las diferentes reacciones de los químicos hacia la electricidad, y de las transformaciones eléctricas hacia energías químicas.Nos ayuda a conocer mejor los fenómenos de la naturaleza que utilizamos como lo son las reacciones.
Características de la electroquímica:
- Estudia la transformación de la energía eléctrica y la energía química.
- Es una rama de la Química.
- Las reacciones se dan mediante un conductor eléctrico.
- El conductor eléctrico mediante el cual interactúan las energías se conoce como electrodo.
- Los electrodos se sumergen en un conductor iónico





Comentarios
Publicar un comentario